科研进展 | 哈兽研汤艳东/蔡雪辉/安同庆团队解析高致病性蓝耳病病毒PRRSV-2组装机制
近日,中国农业科学院哈尔滨兽医研究所汤艳东/蔡雪辉/安同庆团队在高致病性PRRSV-2组装机制研究中取得进展。相关文章发表在Journal of Virology,题为The full-length nsp2 replicase contributes to viral assembly in highly pathogenic PRRSV-2。该研究提出Nsp2参与HP-PRRSV-2的组装新机制。为PRRSV病毒防控以及抗病毒靶点提供参考。PRRSV,猪繁殖和呼吸障碍综合症病毒,能够引起蓝耳病,是影响养猪业的重要病毒,目前,PRRSV包膜蛋白与核衣壳蛋白的识别和组装机制尚不明确。
1、PRRSV-2 N蛋白与不同病毒包膜蛋白之间的相互作用。
病毒膜蛋白包裹病毒N蛋白形成病毒粒子,理论上N蛋白应该与这些病毒膜蛋白发生相互作用。Co-IP实验表明。N蛋白未能与GP2a、GP3、GP4和M蛋白互作(图1A-1C和1E)。然而,N蛋白与GP5发生了互作(图1D)。随后,采用了双分子荧光互补(BiFC)试验也表明只有pVN-N和pVC-GP5组可见互作荧光信号(图1F)。这一结果进一步证实了N蛋白与GP5之间存在相互作用。然而,使用流式细胞仪定量,只有4.46%的细胞呈荧光阳性(图1F)。结果表明,虽然GP5与N蛋白存在相互作用,但其互作可能较弱,可能不足以进行病毒颗粒的组装。

图1:PRRSV-2N蛋白与不同病毒膜蛋白之间的相互作用
2、nsp2 与N 蛋白、病毒膜蛋白存在相互作用。
由于GP5与N蛋白互作较弱,可能存在其他病毒蛋白促进N蛋白与膜蛋白之间的组装。该蛋白很可能是一种跨膜或病毒结构蛋白。已有研究表明nsp2可以包装到病毒粒子中。因此,对nsp2是否参与病毒组装进行了验证。通过Co-IP实验发现nsp2与N蛋白存在相互作用(图2A)。同时,所有这些病毒膜蛋白均能够与nsp2发生互作(图2B-2F)。BiFC实验进一步验证了该结果(图2G)。因此,nsp2可能在PRRSV的组装过程中起着关键作用。
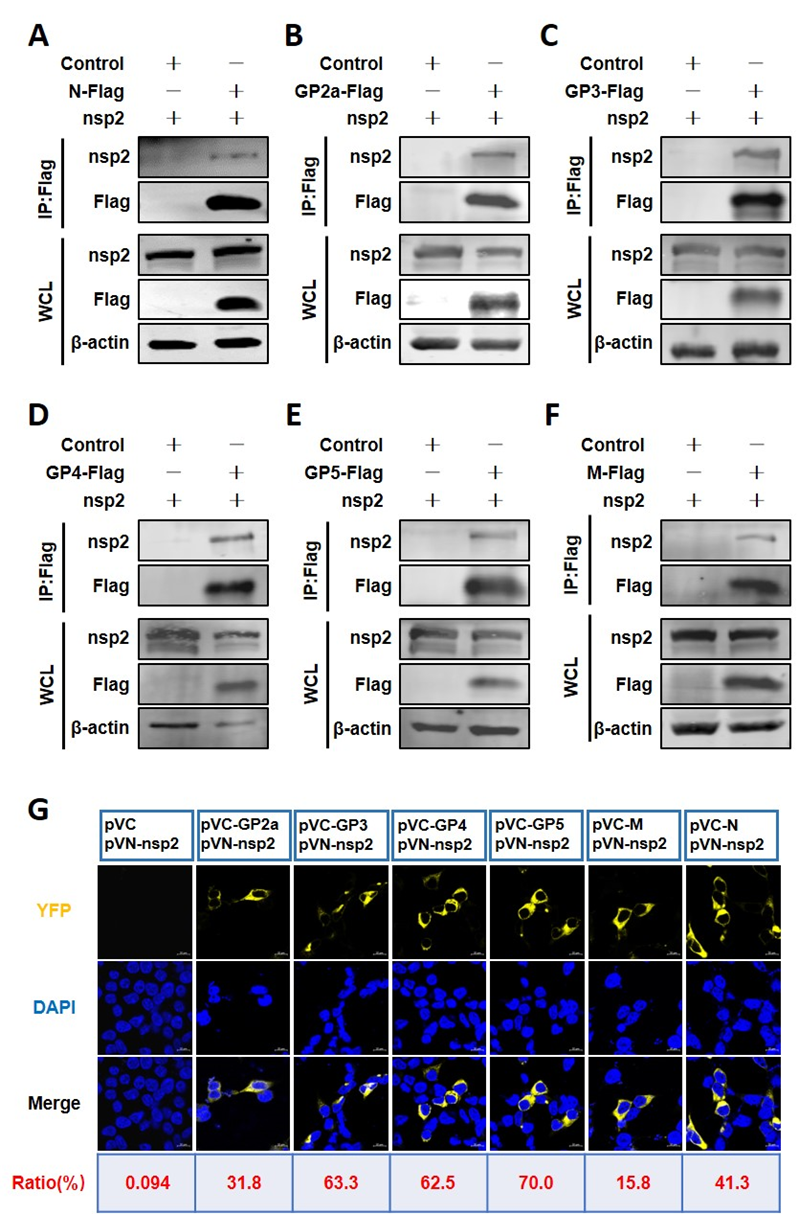
图2:nsp2与N 蛋白、病毒膜蛋白存在相互作用
3、nsp2促进了N蛋白与病毒膜蛋白的组装。
为了证实nsp2是否参与了N蛋白与膜蛋白的组装。在Co-IP实验中,GP2a、GP3和GP4无法与N蛋白结合(如图1)。然而,在nsp2存在的情况下,GP2a、GP3和GP4能够与N蛋白结合(图3A、3B和3C)。不论nsp2是否存在,GP5都能够与N蛋白结合(图1D和3D)。然而,对于M蛋白,只有在nsp2存在的情况下才能与N蛋白结合(图 3E)。
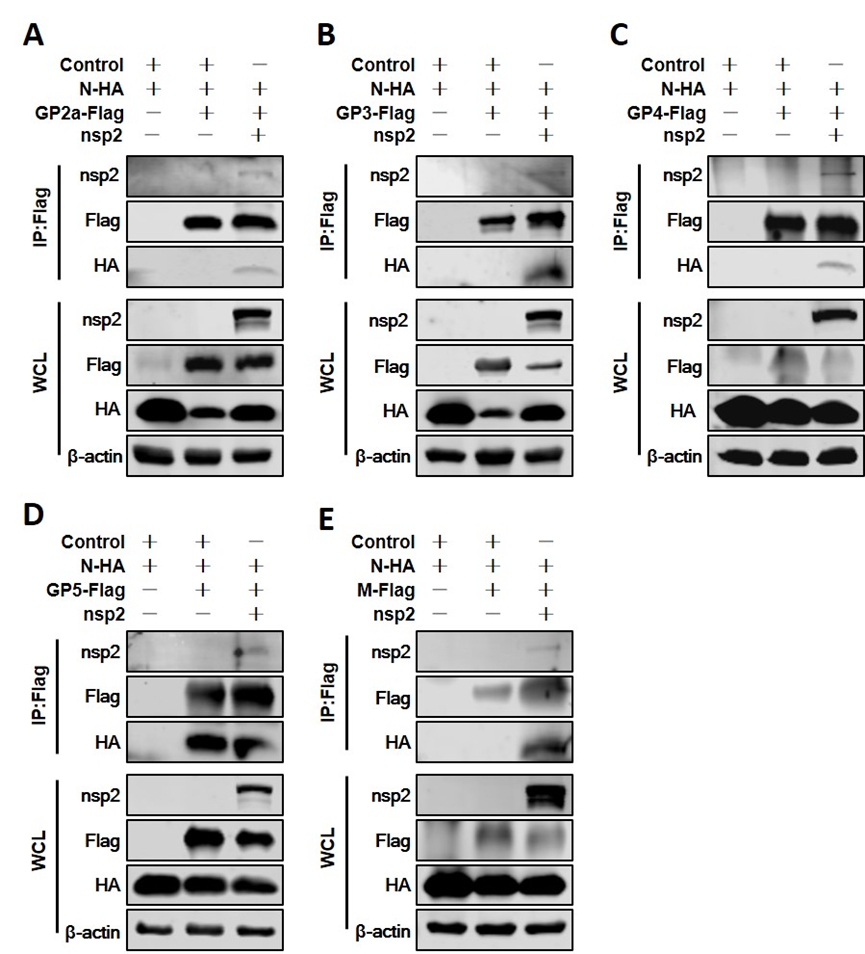
图3:nsp2促进了N蛋白与病毒膜蛋白的组装
本研究最后证实了组装发生在内质网(ER),内质网-高尔基体中间体中(ERGIC), 同时提出了PRRSV的组装模式图。
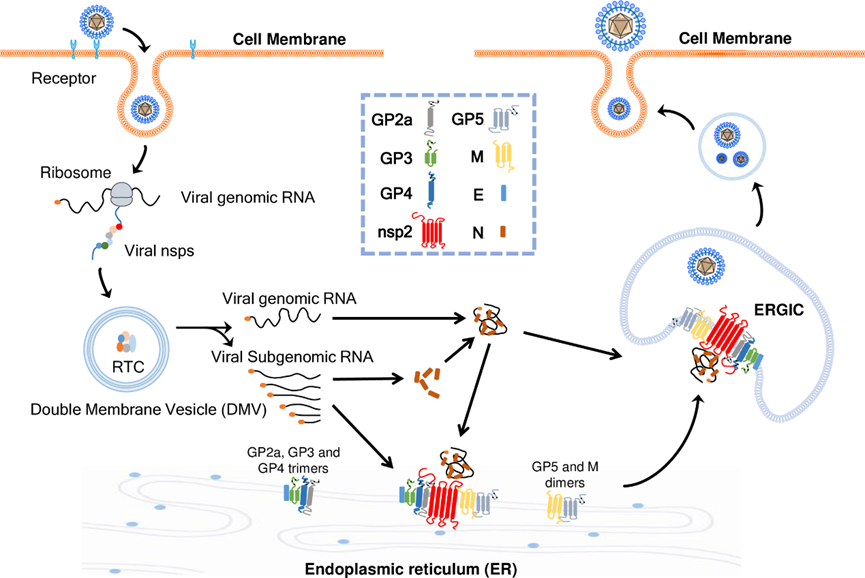
图4:HP-PRRSV组装示意图
总之,该研究阐明了nsp2的一种新功能,为PRRSV的组装提供了新的见解,并增进了对PRRSV生命周期的理解。该研究得到十四五国家重点研发计划“濒危与青藏高原动物疫病防控技术研发与应用”的支持(项目编号2023YFD1801300)。
文章链接:
https://journals.asm.org/doi/10.1128/jvi.01821-24
来源:病毒学界






{{item.content}}