哈兽研:非洲猪瘟病毒调节内质网应激-ATF6-钙轴以促进病毒复制

I 论文导读 |
非洲猪瘟(African Swine Fever, ASF)是由非洲猪瘟病毒(African Swine Fever Virus, ASFV)引起的一种毁灭性传染病,对全球养猪业构成了巨大威胁。尽管已有研究揭示了ASFV感染与内质网(Endoplasmic Reticulum, ER)应激反应之间的关联,但ER应激或未折叠蛋白反应(Unfolded Protein Response, UPR)与ASFV复制之间的具体联系尚不明确。
2024年9月27日,哈兽研研究团队在Emerging Microbes & Infections上发表题为“African swine fever virus modulates the endoplasmic reticulum stress-ATF6-calcium axis to facilitate viral replication”的最新研究论文,本研究旨在深入探讨ASFV如何通过调节ER应激-ATF6-钙轴来促进病毒复制,以期为非洲猪瘟的防控提供新的策略和理论依据。

IF:8.3 中科院1区 | JCR/Q1 微生物 参考译文:非洲猪瘟病毒调节内质网应激-ATF6-钙轴以促进病毒复制 第一作者:Yanjin Wang, Jiaqi Li, and Hongwei Cao 通讯作者:Yuan Sun,Su Li ,Hua-Ji Qiu |
I 主要研究结果 |

图1.ASFV 感染可诱导内质网 (ER) 应激并激活 PAM 中未折叠蛋白反应 (UPR) 的 ATF6 分支
2.ATF6 或 IRE1α-XBP1 通路有利于 ASFV 在 PAM 中的复制
研究结果表明,ATF6或IRE1α-XBP1通路的激活对ASFV在PAM中的复制具有积极作用。通过使用特定的小干扰RNA(siRNA)敲低ATF6或XBP1,研究发现这会减少ASFV的复制。同样,使用ATF6或XBP1特异性抑制剂也能抑制病毒复制。这些发现表明,UPR的这两个分支对于ASFV的有效复制是必要的,暗示了它们在病毒生命周期中的潜在作用。

图2.ATF6 或 IRE1α-XBP1 通路有利于 ASFV 在 PAM 中的复制
3.ASFV 感染破坏细胞内 Ca2+ 稳态
研究表明,ASFV感染会破坏宿主细胞内的钙离子(Ca2+)稳态。研究发现,随着ASFV感染的进展,PAMs中的细胞质Ca2+水平逐渐增加,与病毒生长动力学相一致。此外,当感染更高MOI(病毒粒子与宿主细胞的比例)的ASFV时,细胞质中的Ca2+水平在24小时后显著升高。这些结果表明,ASFV感染影响了细胞内Ca2+的平衡,暗示Ca2+信号可能在ASFV复制中起着关键作用。

图3.细胞质 Ca2+ 对 ASFV 复制至关重要
4.ASFV 激活的 ATF6 通路导致细胞质 Ca2+ 水平升高
研究揭示了ASFV激活的ATF6通路导致细胞质中Ca2+水平的增加。实验中,通过在HEK293T细胞中过表达或敲低ATF6,观察到ATF6的过表达能够以剂量依赖性方式增加细胞质中的Ca2+水平,而ATF6的敲低则降低了Ca2+水平。此外,使用ATF6特异性抑制剂也能减少细胞质中的Ca2+水平。这些结果表明,ATF6通路在调节细胞质Ca2+水平中起着关键作用,并且这种调节作用对于ASFV的复制至关重要。
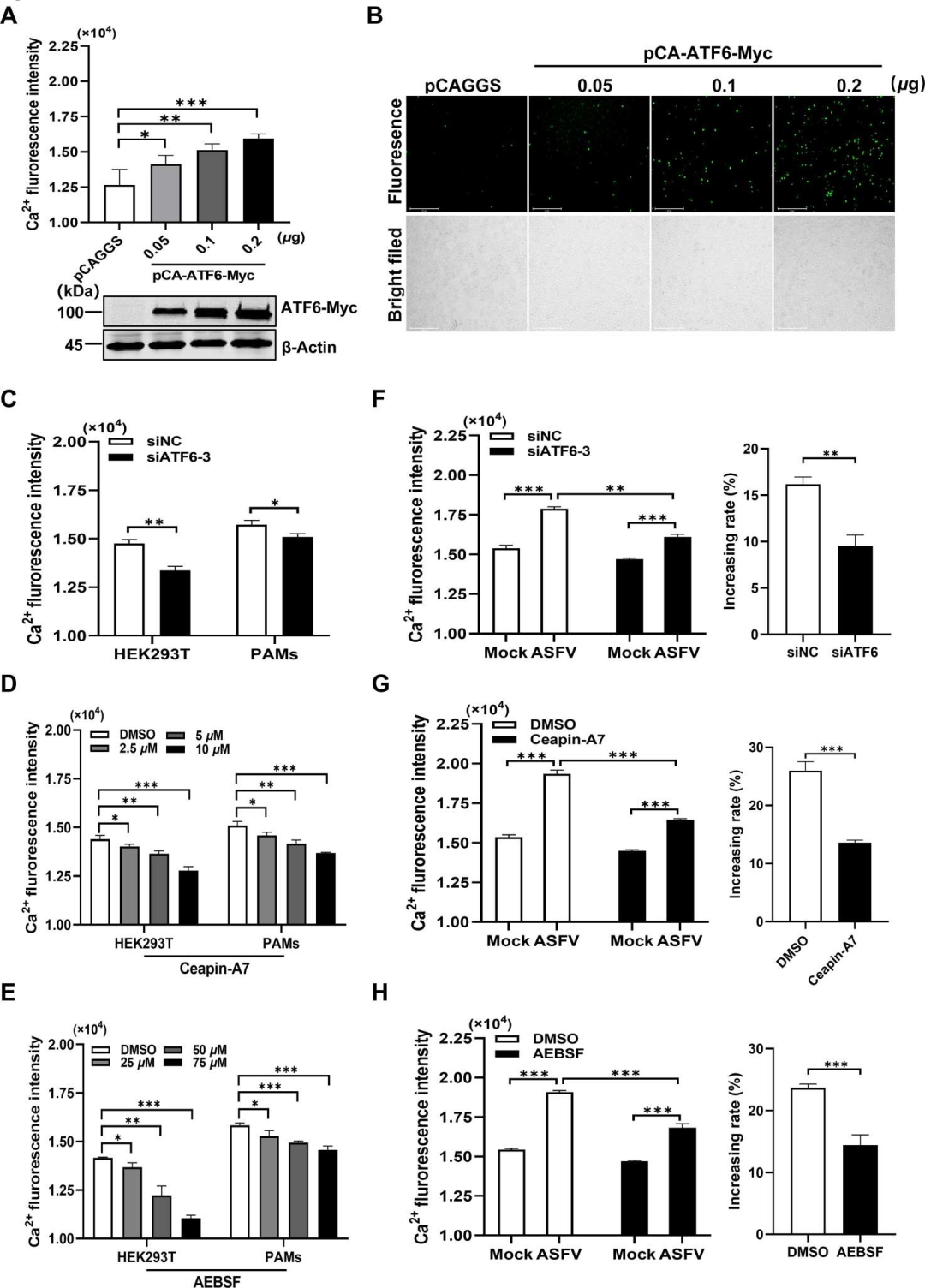
图4.ASFV 激活的 ATF6 通路导致细胞质 Ca2+ 水平升高
5.IP3R 通道负责 ASFV 感染期间 ER 依赖性 Ca2+ 释放
研究表明,在ASFV感染期间,内质网(ER)依赖的钙离子(Ca2+)释放是由肌醇三磷酸受体(IP3R)通道负责的。实验中发现,ASFV感染的PAMs中,IP3R通道的抑制显著降低了细胞质Ca2+水平,而瑞安诺丁受体(RyR)通道的抑制则没有影响。此外,IP3R通道的抑制剂2-APB能够抑制ASFV复制,而RyR通道的抑制剂Dantrolene(Dan)对ASFV复制没有影响。这些结果表明,IP3R通道在ASFV感染引起的ER Ca2+释放和病毒复制中起着关键作用。

图5.IP3R 通道负责 ER 依赖性的 Ca2+ 释放
6.ASFV B117L 蛋白 (pB117L) 参与调节细胞质 Ca2+ 水平
研究发现,ASFV的B117L蛋白(pB117L)参与了调节细胞质中的钙离子(Ca2+)水平。实验结果显示,pB117L能够在转染的HEK293T细胞中以剂量依赖性方式增加细胞质Ca2+水平,表明pB117L在调节细胞内Ca2+平衡中起着重要作用。此外,通过siRNA敲低B117L的表达能够减少ASFV感染条件下的细胞质Ca2+水平,并抑制病毒复制。这些发现揭示了pB117L在ASFV感染过程中通过影响细胞内Ca2+水平来促进病毒复制的潜在机制。
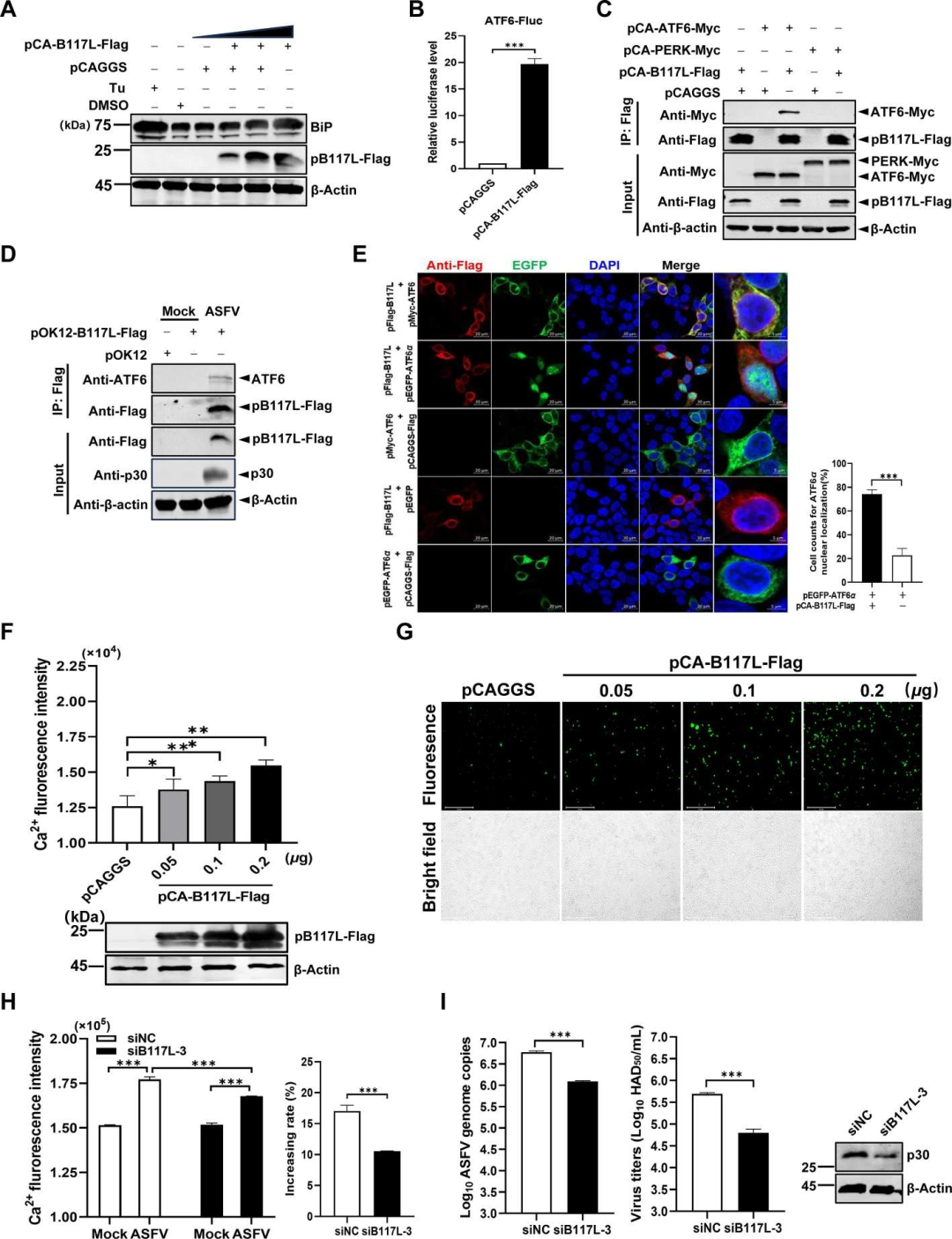
图6.ASFV B117L 蛋白 (pB117L) 对细胞质 Ca2+ 水平的升高至关重要
7.ASFV 感染可诱导猪内质网应激并激活 UPR 的三个分支
研究表明,ASFV感染不仅在体外培养的细胞中,而且在体内也能诱导内质网(ER)应激,并激活未折叠蛋白反应(UPR)的三个分支。通过对感染ASFV的猪的肺和脾脏组织进行分析,研究发现ASFV感染导致这些组织中ER应激标志物BiP的mRNA和蛋白表达水平显著增加。此外,UPR的三个分支中的关键分子,包括PERK、ATF4、IRE1、XBP1、calreticulin(calr)和calnexin(canx)的转录水平也在ASFV感染的猪体内增加。这些结果证实了ASFV感染在宿主体内能够激活UPR的三个分支,进而影响宿主的免疫反应和病毒的复制。
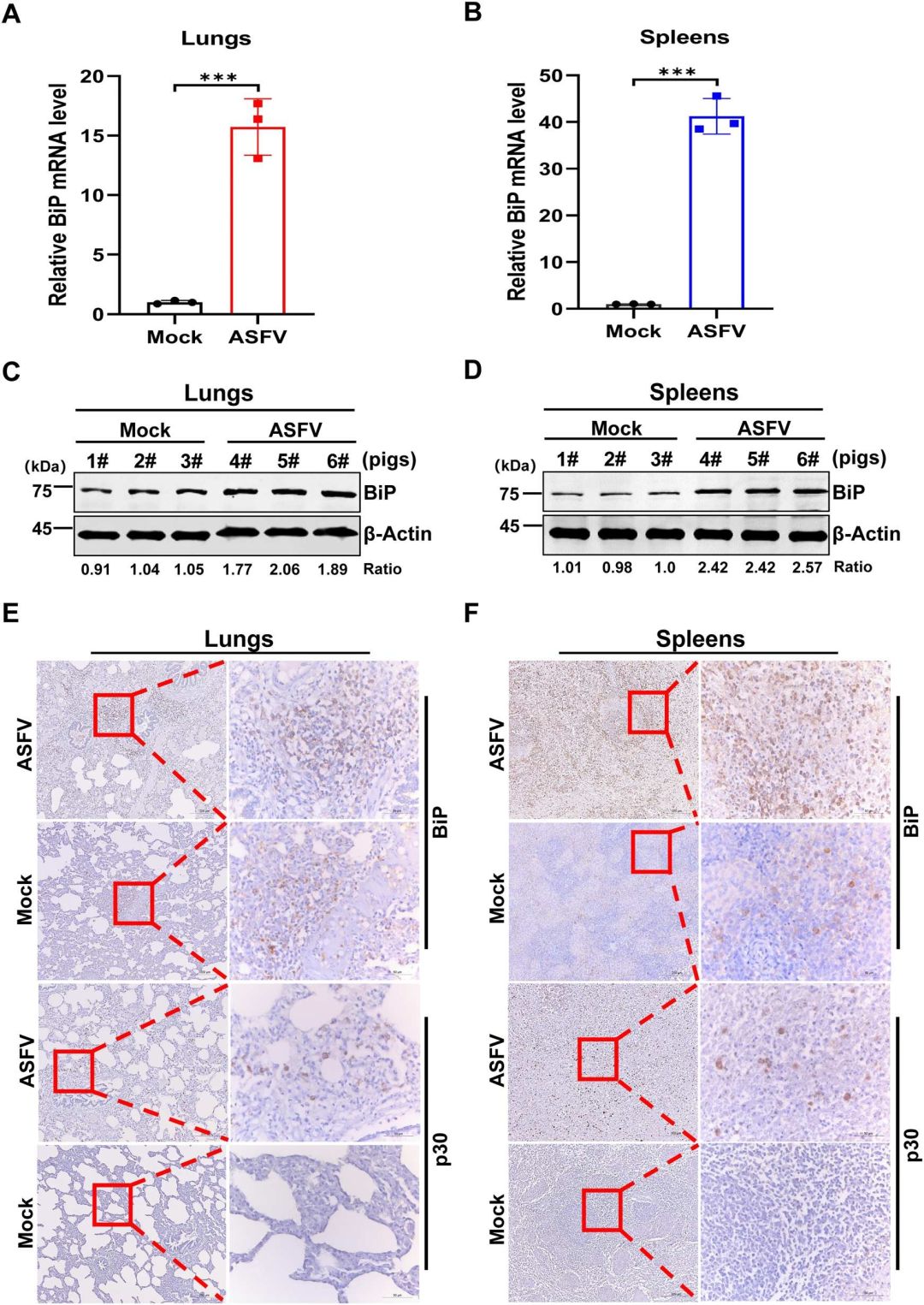
图7.ASFV 感染也会引起猪内质网应激
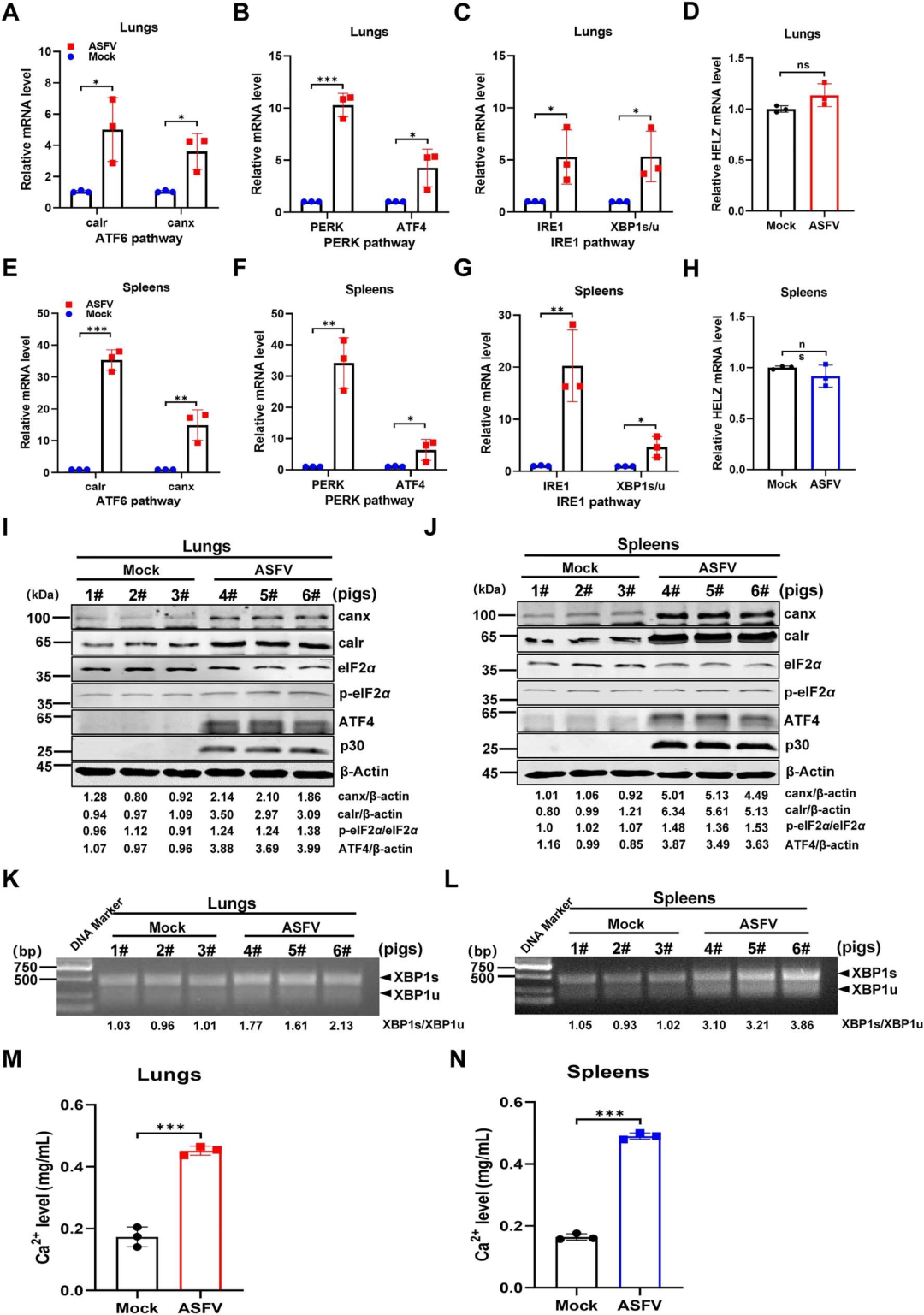
图8.ASFV 感染可激活猪的 UPR 通路的三个分支
| I 研究总结 |
非洲猪瘟病毒(ASFV)感染能够诱导猪体内内质网(ER)应激,并激活未折叠蛋白反应(UPR)的三个主要分支,这一发现揭示了ASFV在宿主体内的复杂作用机制。研究表明,ASFV感染导致ER应激标志物BiP的表达水平显著上升,同时,UPR的三个分支中的关键分子PERK、ATF4、IRE1、XBP1、calreticulin和calnexin的转录水平也在感染猪的肺和脾脏中增加,这表明ASFV感染对宿主细胞的蛋白质稳态造成了深远影响。
研究进一步发现,ASFV感染激活的UPR分支中,特别是ATF6分支的激活与细胞质中钙离子(Ca2+)水平的增加密切相关。这一过程中,肌醇三磷酸受体(IP3R)通道在ASFV感染引起的ER依赖性Ca2+释放中起到关键作用,而这种Ca2+的调节对于病毒复制至关重要。这些发现为理解ASFV如何在宿主细胞内重塑Ca2+信号网络以促进其复制提供了新的视角。
ASFV的B117L蛋白(pB117L)在调节细胞质Ca2+水平中扮演着重要角色。研究发现,pB117L能够诱导ER应激并激活ATF6途径,进而增加细胞质中的Ca2+水平。此外,pB117L的表达水平下调能够减少ASFV感染条件下的细胞质Ca2+水平,并抑制病毒复制,这进一步证实了pB117L在ASFV感染和致病机制中的关键作用,为未来针对ASFV的抗病毒策略提供了潜在的靶点。
源论文链接: https://doi.org/10.1080/22221751.2024.2399945
投稿合作:shouyiyanquan@163.com
| 标注“原创”仅代表原创编译,原文版权归原作者所有。本文仅用作学术交流分享,如有错误或侵权请后台私信订正或删除。 |




{{item.content}}